Asem nitrat
Artikel iki prelu dirapèkaké supaya jumbuh karo wewaton artikel WikipédiaPanjenengan bisa mbiyantu ngrapèkaké artikel iki kanthi mérang dadi paragraf-paragraf utawa wikifikasi. Sawisé dirapèkaké, tandha iki kena dibusak. |
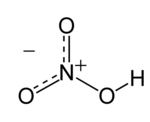
Senyawa kimia asem nitrat (HN03) ya iku sajinis cuwèran korosif kang ora duwé warna, lan wujud asem ngandut racun kang bisa nyebapaké tatu kobong. Larutan asem nitrat kanti kandhutan asem nitrat punjul 86% ingaran asem nitrat kumukus, lan bisa diperang dadi loro jinis asem, ya iku asem nitra kumukus putih lan asem nitrat kumukus abang.[1]
| Asam nitrat | |
|---|---|
| |
 |
 |
| Jeneng Sistematis | Asam nitrat |
| Jeneng liya | Hidrogen Nitrat |
| Identifikasi | |
| Nomor CAS | [7697-37-2] |
| Nomer RTECS | QU5775000 |
| SMILES | O[N+](=O)[O-] |
| Sifat | |
| Rumus molekul | HNO3 |
| Massa molar | 63,012 g/mol |
| Panampilan | Cairan bening tidak berwarna |
| Densitas | 1,51 g/cm³, cuwèran tidak berwarna |
| Titik leleh |
-42 °C, 231 K, -44 °F |
| Titik umob |
83 °C, 356 K, 181 °F (120.5 °C (larutan 68%)) |
| Kelarutan dalam air | tercampurkan |
| Viskositas | ? cP at ? °C |
| Momen dipol | 2,17 ± 0,02 D |
| Bahaya | |
| Klasifikasi EU | Oksidan (O)Korosif (C) |
| NFPA 704 | |
| Frasa-R | Cithakan:R8, Cithakan:R35 |
| Frasa-S | (S1/2), Cithakan:S23, Cithakan:S26, Cithakan:S36, S45 |
| Titik murub | tidak tersedia |
| Senyawa kagandhèng | |
| Senyawa kagandhèng | Asam nitrit Dinitrogen oksidaDinitrogen pentoksida |
| Kajaba dinyatakaké suwaliké, data ing dhuwur lumaku ing kaanan standar (25 °C, 100 kPa) | |
Sajarah
besutAsam nitrat kapisan kali ingsintesis sakiwa-tengené 800 M déning alkimiawan Jabir ibnu Hayyan, kang uga nemu ingstilasi modhèren lan prosès kimiawi dhasar liyané kang isih digunakaké nganti saiki.[2]
Kimia
besutAsam nitrat ya iku larutan asem kuwat kang duwé aji pKa gedhene -2. Sajeroning banyu, asem iki terdisosiasi dadi ion-ioné, ya iku ion nitrat NO3− lan ion hidronium (H3O+). Uyah saka asem nitrat ingaran minangka uyah nitrat (contoné kayat kalsium nitrat utawa barium nitrat). Sajeroning témperatur ruangan, asem nitrat awujud uwab kang wernané abang utawa kuning.
Asam nitrat lan uyah nitrat ya iku salah sijiné kang béda kanti asem nitrit lan uyahe, uyah nitrit.
Sifat
besutAsam nitrat murni (100%) wujud cuwèran ora duwé warna kanti bobot jinis 1.522 kg/m³. Dhèwèké mbeku ing suhu -42 °C, minangka kristal-kristal putih, lan umop ing 83 °C. nalika umop ing suhu kamar, turahan dekomposisi (penguraian) sapérangan kanti pmbentukan nitrogen ingoksida sawisé reaksi:
- 4HNO3 → 2H2O + 4NO2 + O2 (72 °C)
kang berarti yèn asem nitrat anhidrat sebaiknya disimpen ing ngisor 0 °C kanggo ngindari penguraian. Nitrogen dioksida (NO2) tetep larut sajrone asem nitrat kang bisa nggawé warna kuning, utawa abang ing suhu kang luwih dhuwur. Ingendi asem murni cenderung ngetokaké ablok putih nalika terpapar ing udara, asem kanti nitrogen ingoksida terlarut ngetokaké uwab wernané coklat keabang-abangan, kang nggawé dijuluki "asem ablok abang" utawa "asem nitrat kang duwé ablok". Asam nitrat berablok uga dirujuk minangka asem nitrat 16 molar (wujud paling pekat asem nitrat ing témperatur lan tekanan baku).
Asam nitrat bercampur karo banyu sajrone pira-pira proporsi lan ingstilasi ngaselaké azeotrop kanti konsèntrasi 68% HNO3 lan titik didih 120,5 °C ing 1 atm. Turah rong hidrat kang dingertèni, ya iku monohidrat (HNO3·H2O) lan trihidrat (HNO3·3H2O).
Nitrogen oksida (NOx) larut sajeroning asem nitrat lan sipat iki ngribawani kabèh sipat fisik asem nitrat kang tergantung ing konsèntrasi oksida (kaya ta tekanan uwab ing saknduwre cair, suhu didih, lan warna kang dijelase ing nduwur).
Peningkatan konsèntrasi asem nitrat kadayan déning dekomposisi termal utawa cahya, lan hal iki bisa nimbulake sejumlah variasi kang ora bisa diabaikan ing tekanan uwab ing sakduwure cuwèran amarga nitrogen oksida kang diprodhuksi bakal terlarut sapérangan utawa sekabehane ing sajrone asem.
Sifat-sipat asem
besutIngendi asem ing lumrahé, asem nitrat bereaksi kanti alkali, oksida basa, lan karbonat kanggo minangka uyah, kaya ta amonium nitrat. amarga duwé sipat mengoksidasi, asem nitrat ing lumrahé ora nyumbangake protone (ya iku, dhèwèké ora ngecolake hidrogen) ing reaksi kanti logam lan uyah kang dikasilake racaké ana sajrone keadaan teroksidasi kang luwih dhuwur.amarga, perkaratan (korosi) tingkat dhuwur bisa kadadéan. Perkaratan bisa dicegah kanti penggunaan logam utawa aloi anti karat kang tepat.
Asam nitrat duwé tetapan ingsosiasi asem (pKa) 1,4: sajrone larutan akuatik, asem nitrat meh sekabehane (93% ing 0.1 mol/L) terionisasi dadi ion nitrat NO3 lan proton terhidrasi kang misuwur minangka ion hidronium, H3O+.
HNO3 + H2O → H3O+ + NO3-
Sifat-sipat oksidasi
besutReaksi kanti logam
besutminangka salah sijiné oksidator kang kuwat, asem nitrat bereaksi kanti hebat kanti sapérangan besar bahan-bahan organik lan reaksine bisa bersifat èksplosif. Produk akhire bisa bervariasi tergantung ing konsèntrasi asem, suhu, sarta reduktor. Reaksi bisa kadadéan kanti kabèh logam kajaba deret logam mulia lan aloi katentu. Karakteristik iki nggawé asem nitrat dadi agen kang lumrahé digunakaké sajrone uji asem. minangka kaidah kang umum, reaksi oksidasi mligi kadadéan kanti asem pekat, memfavoritake pembentukan nitrogen dioksida (NO2).
Cu + 4H+ + 2NO3- → Cu+2 + 2NO2 + 2H2O
Sifat-sipat asem cenderung mendominasi ing asem nitrat encer, dipeloni kanti pembentukan nitrogen oksida (NO) kang luwih diutamakakel.
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
amarga asem nitrat merupbakal oksidator, hidrogen (H2) jarang terbentuk. Hanya magnesium (Mg), mangan (Mn), lan kalsium (Ca) kang bereaksi kanti asem nitrat ingngin lan encer kang bisa ngaselake hidrogen:
Mg(s) + 2HNO3(aq) → Mg(NO3)2(aq) + H2(g)
Asam nitrat mampu menyerang lan nglarutakE KABEH logam kang ana ing tabel periodik, kajaba emas lan platina.
Pemasifan
besutKendati kromium (Cr), wesi (Fe), lan alumikium (Al) bakal terlarut sajrone asem nitrat kang encer, asem pekat bakal minangka salah sijiné lapisan logam oksida kang nglindungi logam saka oksidasi luwih lanjut. Hal iki ingaran kanti pemasifan. Konsentrasi pemasifan kang umum berkisar saka 18% sampai 22% abot.
Reaksi kanti non-logam
besutNalika asem nitrat bereaksi kanti pira-pira unsur non-logam, kajaba silikon sarta halogen, racaké dhèwèké bakal mengoksidasi non-logam mau marang keadaan oksidasi paling dhuwur kanti asem nitrat dadi nitrogen dioksida kanggo asem pekat lan nitrogen monoksida kanggo asem encer.
C + 4HNO3 → CO2 + 4NO2 + 2H2O
utawa
3C + 4HNO3 → 3CO2 + 4NO + 2H2O
Sintesis lan produksi
besutAsam nitrat digawé kanti nyampur nitrogen ingoksida (NO2) karo banyu. ngaselake asem nitrat kang murni racaké nglibatake distilasi kanti asem sulfat, amarga asem nitrat minangka salah sijiné azeotrop karo banyu kanti komposisi 68% asem nitrat lan 32% banyu. Asam nitrat kualitas komersial racaké duwé konsèntrasi antarané 52% lan 68% asem nitrat. Produksi komersial saka asem nitrat nglewati prosès Ostwald kang tinemu déning Wilhelm Ostwald.
Asam nitrat bisa digawé kanti mereaksikake 200 gram potasium nitrat (KNO3) marang sajrone larutan asem sulfat (H2SO4) 96% 106 ml, banjur mendistilasi campuran iki ing titik didih asem nitrat (83 °C) nganti amung nurahake kristal putih potasium hidrogen sulfat (KHSO4), ing tabung reaksine.
Penggunaan
besutAsam nitrat racaké digunakaké ing laboratorium minangka reagen. Larutan iki uga kanggo nggawé bahan-bahan kang bisa njeblok kaya ta nitrogliserin, trikitrotoluena (TNT) lan Siklotrimetilenatrikitramin (RDX), lan uga kanggo gawé amonium nitrat.
Asam nitrat uga digunakaké ing pérangan metalurgi lan pengilangan amarga bisa bereaksi kanti metal. nalika dicampurkan kanti asem klorida, maka campuran iki bakal minangka aqua regia, siji saka pira-pira reagen kang bisa nglarutake emas lan platinum.
Asam nitrat uga wujud komponèn saka udan asem.
Cathetan sikil
besut- ↑ nitrat, (Kaunduh1/11/12)
- ↑ sejarah-asem-nitrat, (Kaunduh 21/11/12).
